谈糖不色变
硫酸软骨素(CS)科学解读
2025年08月07日 17:11
前言
硫酸软骨素是一种结构复杂的糖胺聚糖,广泛分布于动物组织的细胞外基质和细胞表面,主要以与蛋白质结合的蛋白聚糖形式存在。目前,硫酸软骨素在国外主要应用于骨关节炎的预防和治疗,国内则多用于心血管疾病和眼科疾病。硫酸软骨素作为症状慢作用药物和膳食补充剂的普及应用,有效地改善了骨关节炎人群的生活质量,减少了非甾体抗炎药的消耗和不良反应。近年来,对其生理功能的深入研究表明,硫酸软骨素具有多种独特的生物活性,使其在抗寄生虫和病毒感染、再生医学、抗肿瘤、组织工程等领域有着引人瞩目的应用潜力。
不同来源的硫酸软骨素的结构呈现出高度的不均一性,表现在硫酸化位置、硫酸化程度、相对分子质量、葡糖醛酸和艾杜糖醛酸的相对量等。来源于不同物种或同一物种不同组织的硫酸软骨素,其结构不一定相同,甚至同一组织内的硫酸软骨素,其结构也会随生理、病理状态及发育阶段而变化。硫酸软骨素二糖序列测定的方法和结构的完整解析尚不成熟,是其结构-功能关系和生理作用机制研究中有待突破的挑战性课题。
硫酸软骨素的生化性质、药理活性和临床功效与其结构有着密不可分的关系。商品硫酸软骨素是从动物的软骨组织经提取纯化过程制备的,其来源多样,结构不一。制备工艺和杂质等许多因素也会对硫酸软骨素的临床效果产生影响。硫酸软骨素的生物利用度目前仍存在争议,治疗骨关节炎的作用机制尚有待确切诠释。这些都是当前阻碍硫酸软骨素的开发和应用的亟待解决的问题。
硫酸软骨素(chondroitin sulfate,CS)是一类硫酸化的酸性黏多糖(acid mucopolysaccharide),黏多糖现多称糖胺聚糖(glycosaminoglycan,GAG)。根据单糖组成的不同及硫酸基位置、数量的不同,CS可分为CS-A、CS-B、CS-C、CS-D和CS-E等类别。有些文献记载,CS的首次发现始于1884年Krukenberg等[]的研究。实际上早在1861年Fischer和Boedeker[]就从软骨中提取分离出CS,因此CS的研究至今已有150年的历史。但不同类别CS的结构直至20世纪60年代才初步明确。
硫酸软骨素(CS)是共价连接在蛋白质上形成蛋白聚糖(PG)的一类糖胺聚糖(GAG)。CS广泛分布于动物组织的细胞外基质(ECM)和细胞表面,糖链由交替的葡糖醛酸(GlcUA)和N-乙酰半乳糖胺(GalNAc,又称N-乙酰氨基半乳糖)二糖单位组成,通过一个四糖连接区连接到核心蛋白的丝氨酸(Ser)残基上。在糖醛酸水平高度修饰的CS链称为硫酸皮肤素(DS)。长期以来,CS/DS仅被认为是PG的主要组分,作为细胞的惰性结构元件,参与维持组织结构的稳定。其重要的生理功能一直少受关注,其应用也并不广泛。近些年来,这类糖胺聚糖的分离纯化、工业制备、结构表征、生理功能研究和临床应用,发生了激动人心的变化,成为人们关注的焦点。
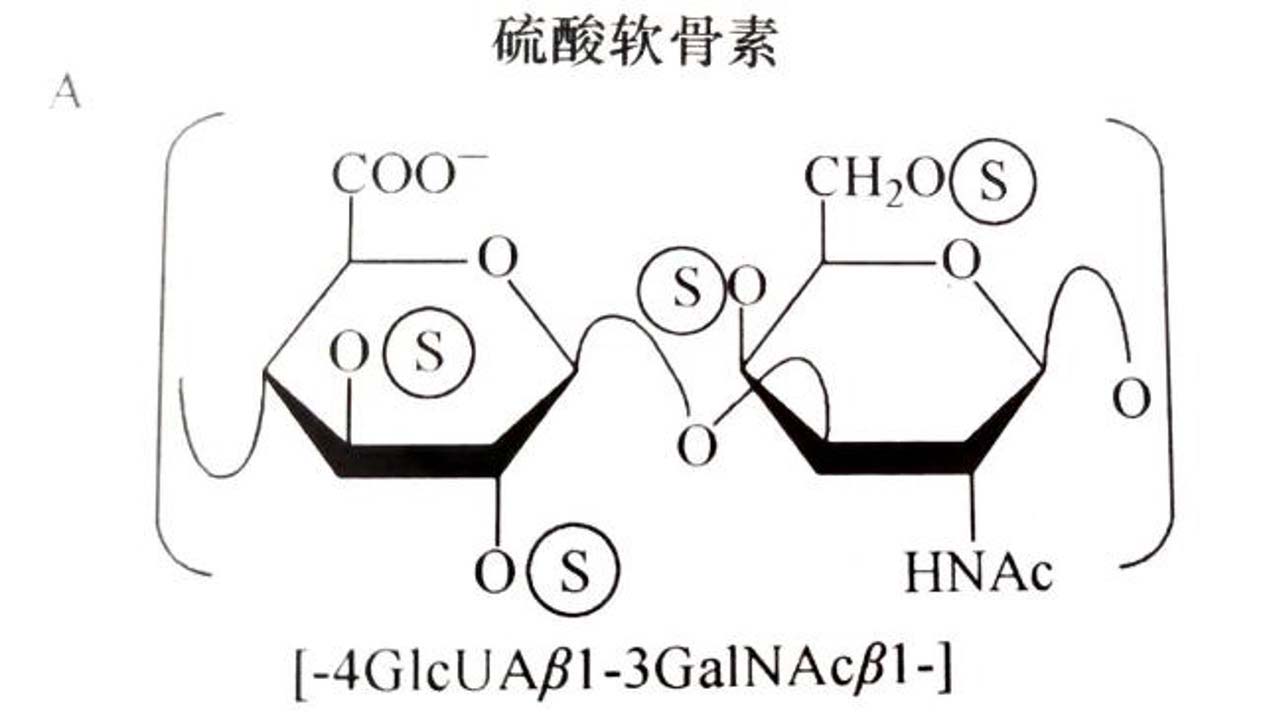
CS早1884年就被分离出来,但其单糖的性质和结构直到1925年才由Levene做了报道,其组成成分是等摩尔比的D-葡糖醛酸、D-半乳糖胺、乙酸和硫酸[]。CS的重复二糖单位是[→4GlcUAβ1→3GalNAcβ1→]。哺乳动物的CS常在GalNAc的C-4或(和)C-6上硫酸化。CS结构示意图见图1A。术语CS-A系指富含[GlcUA-GalNAc(4S)](A-单位)的CS;CS-C则系指富含[GlcUA-GalNAc(6S)](C-单位)的CS。在动物世界,特别是海洋非脊椎动物中,除了这些常见的A-单位和C-单位外,还发现硫酸化型式多样和中性糖分枝的多种二糖单位。这些二糖单位文献上称为CS的二糖异构体(isomeric form)或变体(variant),这些二糖名称和结构见图1B。
图1A CS结构示意图
图1B CS二糖名称和结构
无硫酸化的O-单位在牛、猪和鸡的商品CS样本中的相对含量报道为6.0%~8.0%,鲸鱼为9.0%。在某些软体动物,如泥蜗牛中则高达50%,也是秀丽隐杆线虫(Caenorabditis elegans)和哺乳动物血液中低硫酸化PG(bikunin)的主要二糖单位。
一硫酸化的A-单位和C-单位,这是大多数CS链的主要二糖单位,其相对含量则随物种变化。牛、猪和鸡的商品CS样本中,A/C比值分别为1.5~2.0、4.5-7.0和3.0-4.0,A单位高于C单位,是主要的二糖单位。鲨鱼软骨CS的A/C比值为0.45~0.70,C单位则高于A单位,是主要的二糖单位。鳐鱼软骨CS的A/C比值为1.00~1.40,又与鲨鱼的不同。
二硫酸化二糖单位有B-、D-、E-、K-、和L-单位等。
D-单位[GlcUA(2S)-GalNAc(6S)],这是鲨鱼软骨CS的表征组分(20%)。鲨鱼CS有时也称CS-D。D-单位和B-单位[GlcUA(2S)-GalNAc(4S)]常不予区分。
E-单位[GlcUA-GalNAc(4S,6S)],这是乌贼软骨CS的主要或表征性二糖单位(>60%),在乌贼角膜和海参体壁中也含存。哺乳动物肥大细胞亚族、天然杀伤细胞和嗜碱性白细胞具有富含E-单位的CSPG,脑组织的PG如淀粉样蛋白聚糖(appican)也含存这种表位(抗原决定部位)。
K-单位[GlcUA(3S)-GalNAc(4S)]和L-单位[GlcUA(3S)-GalNAc(6S)]两者皆为葡糖醛酸C-3位上硫酸化的二糖单位。早在1960年就有人报道含存于鲨鱼软骨的CS链中。在皇蟹、海参体壁和乌贼软骨中也含存。
M-单位[GlcUA(3S)-GalNAc(4S,6S)]或T-单位[GlcUA(2S)-GalNAc(4S,6S)]两者是三硫酸化的二糖单位,也见于乌贼软骨CS链中。
F-单位[GlcUA(3-α-L-Fuc)-GalNAc(4S)]和G-单位[GlcUA-GalNAc(4S) (6β-D-Glc)]两者皆为中性糖分枝的二糖单位。F-单位的分枝糖是L-岩藻糖,可见于皇蟹和海参,G-单位的分枝糖是D-葡萄糖,在乌贼软骨和皮肤中含存。
那么,国内外CS发展简史是如何的?
1958年,我国于重庆西南制药厂投产CS,后产地增加至多个省市,产品别名康得灵。1977年,成都制药三厂投产CS-A。1973年,上海医药工业研究院根据成都制药三厂、上海市食品公司制药厂、沈阳市食品公司生物制药厂及江西省和吉林省有关厂家的资料整理硫酸软骨素钠(CS-Na)的生产工艺,列入汇编,相对分子质量(M)定为20000-50000。
在CS的质量控制方面,我国最初执行的是地方标准,后被国家卫生部的部颁标准收录,2002年列为国家药品标准,现被收载于《中华人民共和国药典》2010年版二部。2002年的国家药品标准中收载的CS原料药有硫酸软骨素A钠(CS-A-Na)和供注射用的CS,并规定其来源应为猪喉骨、鼻中骨、气管等软骨组织;CS制剂有CS注射液、CS-A-Na胶囊和CS滴眼液。2010年版中国药典中收载的CS原料药是CS-Na,包括CS-A和CS-C,制剂包括CS-Na片和CS-Na胶囊,规定来源与国家药品标准相同。
在国外,CS于2003年被美国药典-处方集(USP-NF)第一增补本收载,2006年被欧洲药典(EP)5.6收载,在英国药典(BP)中也有收录。在欧洲,CS作为处方药用于治疗骨关节炎已有超过20年的历史。1992年,美国Nutramax Lab.,Inc.的CS和氨基葡糖的复合产品Cosamin DS®被美国FDA批准为膳食补充剂(dietary supplement),用于改善关节疾病。20世纪90年代中期以前,欧洲、北美等地所用CS的原料主要来自当地饲养的牛、羊等动物。后来由于疯牛病的影响,欧美等国家开始在全球市场采购以猪、鱼和禽软骨加工生产的CS。
一个是提取来源的CS。
硫酸软骨素传统上主要从动物组织中通过化学水解法和酶水解法提取,其中陆生动物(如牛、猪、鸡的软骨)和海洋生物(如鲨鱼、鳕鱼、鱿鱼、海参)是主要原料。牛和猪的软骨富含CS-A和CS-C,而鲨鱼软骨则以CS-D和CS-E为主,具有更高的硫酸化程度和潜在的抗肿瘤活性。海洋无脊椎动物(如鱿鱼和海参)提供的CS结构独特,例如海参体壁中的硫酸软骨素(fCS)因其高硫酸化特性,在免疫调节方面表现出更强的生物活性。然而,动物提取法面临原料供应受限、病原体污染风险(如疯牛病)以及伦理问题等挑战,促使研究者探索更可控的替代来源。
另一个则是生物合成来源的CS。
硫酸软骨素(CS)的生物合成主要通过微生物工程、哺乳动物细胞培养和体外酶法合成实现。相较于传统动物提取法,生物合成技术具有结构可控、无动物源污染、可规模化生产等优势,尤其适用于医药等高附加值领域。
(1)微生物工程生产:微生物宿主(如大肠杆菌、枯草芽孢杆菌)经基因改造后,可合成CS或其前体(如软骨素)。关键步骤包括:引入软骨素合成酶基因(如kfoA、kfoC),催化葡萄糖醛酸(GlcA)和N-乙酰半乳糖胺(GalNAc)交替连接形成软骨素链;表达硫酸转移酶(如CHST11、CHST13),在特定位点(如4-O或6-O)引入硫酸基团,生成CS-A或CS-C;优化发酵条件,通过碳源调控(如葡萄糖/半乳糖)和pH调节提高产量。例如,重组大肠杆菌在优化培养基中软骨素产量可达5.2 g/L[]。具有成本低、周期短的优势,也面临着硫酸化效率低,需进一步优化酶系统的挑战。
(2)哺乳动物细胞培养:中国仓鼠卵巢细胞(CHO细胞)是主流生产平台,能够合成结构更接近天然CS的产物。在天然酶系统CHO细胞自身表达CS合成酶(如CSGALNACT1)和硫酸转移酶,可直接分泌硫酸化CS[];通过基因增强策略,过表达CHST11可提高6-O硫酸化比例,获得CS-C为主的产物。主要用于医药级CS生产,如关节注射液或组织工程支架(FDA批准的部分CS药物即来源于此)。但也存在培养成本高,产量较低(通常<1 g/L)的局限性。
(3)体外酶法合成:体外酶法合成硫酸软骨素(Chondroitin Sulfate, CS)是一种通过纯化酶系统在体外重构CS生物合成途径的技术。该方法利用核心酶系糖基转移酶(如*CSGALNACT1/2*)延伸糖链,硫酸转移酶(如CHST15)定点硫酸化,在严格控制的环境条件下,在体外重构CS合成途径,实现CS链的精确合成和修饰。例如,利用CHST11和CHST13组合合成高硫酸化CS-E,用于神经再生研究[]。体外酶法可生产动物中罕见的CS结构(如CS-K),但也面临着酶纯化成本高,规模化难度大的问题。
在医药领域中的潜在应用
(1)用于抗寄生虫和病毒感染。特定结构的CS参与各种微生物的感染过程,提示CS/DS寡糖序列与微生物间存在特殊的相互作用,因此可被发展成为抑制感染的药物。
(2)应用于再生医学。CS/DS链的生物活性可能涉及多种生长因子。特定的CS/DS链募集生长因子/神经营养因子和(或)增强它们的活性,提示微量的功能性CS/DS链能够替代信号蛋白用于组织再生。
(3)发展为抗肿瘤药物。CS/DS链的特定结构域参与肿瘤细胞的增殖和转移。对特定的CS/DS链糖序列的检测和鉴定对肿瘤治疗会有重要帮助。某些CS衍生物具有抗肿瘤活性。
(4)作为载体,应用于基因治疗和抗肿瘤药物传递系统。
在组织工程中的应用
由于CS用于体内移植或注射时无炎症和变态反应,在动物体内可被降解为氨基葡糖,参与代谢,表现出良好的生物相容性和生物可降解性,因而在组织工程中得到广泛的应用。CS在复合支架中主要起到改善细胞的黏附和调节支架降解性能的作用。CS作为一种重要的GAG参与多种组织工程支架的制备,具有改善细胞黏附和亲和性、调节支架降解速度、调解支架力学强度和增加支架生物相容性等作用,是一种不可或缺的成分。其上述特性使得CS作为用于组织工程修复的复合材料之一,在皮肤、神经、心脏、眼、骨和软骨组织工程中有良好的应用。
在眼科中的应用
硫酸软骨素(CS)是糖胺聚糖(GAG)类物质,是构成细胞外基质(ECM)的主要成分,对维持细胞环境的相对稳定性和正常功能具有重要作用。CS可抑制磷酸二酯酶活性,增加环磷腺苷含量和激活脂解酶,促进脂质代谢,从而加速眼肌坏死的修复和促进末梢循环,具有保护前房的功能。CS通过促进基质的生成,为细胞的迁移提供构架,有利于角膜上皮细胞的迁移,从而促进角膜创伤的愈合。CS还可通过改善血液循环,加速新陈代谢,促进渗出液的吸收及炎症的消除。CS在眼科的应用主要有治疗角膜损伤,用于角膜保存,缓解干眼症和作为黏弹剂用于眼科手术。
在心血管疾病中的应用
硫酸软骨素(CS)是一类重要的糖胺聚糖(GAG),临床上可用于防治动脉粥样硬化(atherosclerosis,AS)、心绞痛、高脂血症等。CS可以清除血液中的脂质,清除心脏周围血管的胆固醇,防治AS,具有增强脂质在细胞内转换的作用。能增加细胞的信使RNA(mRNA)和DNA的生物合成以及促进细胞代谢。对实验性动物模型具有抗AS及抗致粥样斑块形成作用;增加AS的冠状动脉分枝或侧支循环,并能加速实验性冠状动脉硬化或栓塞所引起的心肌缺血性坏死或变性的愈合、再生和修复。CS具有缓和的抗凝血作用[],每1 mg CS-A相当于0.45单位肝素(Hep)的抗凝血活性。这种抗凝血活性并不依赖于抗凝血酶Ⅲ发挥作用,而可以通过血纤蛋白原系统发挥抗凝血活性。临床用于冠心病患者,可去除或减少在动脉和静脉壁上沉积的脂质,对心绞痛、心肌梗死、冠状动脉机能不全等具有显著的防治作用。在日本、中国等国有广泛应用。
在治疗骨关节炎方面的应用
应用CS或将CS与GlcNH2或其他组分复合的药物或药效营养剂(nutriceutical)治疗OA,现今在世界各国已经很普及。
在欧洲,CS作为处方药物在欧洲国家用于治疗OA已有甚长历史。欧洲抗风湿病联盟(EuropeanLeague Against Rheumatism,EULAR)根据大量临床研究的证据及其整合分析(meta-analysis)的结论,于2003年推荐CS为治疗OA的慢作用药物(Symptomatic Slow - Acting Drugfor Osteoarthritis,SYSADOA)[],将口服CS列为膝OA治疗证据1A,推荐强度A,这都代表治疗策略的最高水平。
在美国,1992年美国Nutramax Lab.应用西班牙Bioiberica AS高纯度、低MrCS与GlcNH2,复合生产的专利品牌Cosamin®胶囊制剂,经FDA按《药品、食品和化妆品管理办法》审核批准投放市场。每胶囊含CS钠盐400mg,GlcNH2·HCl 500 mg和抗坏血酸锰(锰为糖基转移酶的共因子)。美国FDA是世界上最严格的药品食品安全监管机构之一。CS和GlcNH2,这类用于替代治疗OA的产品不被批准为药品,而被认定为膳食补充剂(dietary supplement)。
其他地区,如在澳大利亚, CS产品属于营养保健药品,大多与GlcNH2制成复合制剂,用于OA的防治。在中南美洲,CS与GlcNH2复合的处方药物的研发与应用方兴未艾,呈现良好的市场前景。其中巴西国药物监管机构Anvisa效仿欧洲将CS与GlcNH2,制剂定位为处方药。在日本厚生省,将CS与GlcNH2产品定位为药效营养品,其市场规模也超过亿美元,原料主要从中国进口。在韩国,CS与GlcNH2产品为处方药物。中国是全球CS和GlcNH2生产大国。近数年来CS的年出口量超过3000t。中国药典与国家药品标准收载有药品成分猪源CS及其制剂的质量标准,适应证定为降血脂药。中国至今未形成治疗OA的CS终端产品产业。
现今,药物成分和膳食补充剂或药效营养剂成分CS及其制剂在全球已形成一定规模膳的产业,应用CS来治疗OA症状也很普及,但由于存在下述三个方面的问题,仍然是有争议的课题。首先,膳食补充剂或药效营养剂工业与医药工业相比较,生产质量不够规范,CS的来源、纯度和制剂的质量管理有待完善与提高;其次,口服摄入CS的生物利用度常不被接受且颇多争议;第三,CS化学结构高度不均一,CS治疗OA功效的机制有待确切诠释。对于这些存在的问题,学术界与产业界在过去,特别是近20年已进行了广泛深入的研究,发表了大量研究报告,取得很多成果。
其中针对口服CS在人体和动物体内的生物利用度,一直是争议不休的课题。Morrison早在1977年曾报道,CS的整体吸收率极低,估计在0~8%。Baici等[]报道,口服摄入CS 1-2 g后,血清CS浓度不发生统计学变化。Ronca等和Conte等报道,口服CS的生物利用度分别为12%和13.2%。Ronca和Conte还共同研究了部分解聚的鲨鱼CS在人体中的代谢变化趋向(metabolicfate)。他们将部分解聚的CS(平均Mr 7.5×103),Mr范围(5~10)×103,4S/6S为1:3),以肌内注入0.2 g和口服摄入1.2 g分别投予年龄25~53岁的5男5女健康志愿者。肌内注入的,血浆水平在90 min内增加到浓度峰值。峰值浓度、消除半衰期和表观分布容积分别为3.8 μg/mL、275 min和0.40 mL/g,约37%注入的CS在24 min内以高Mr和低Mr衍生物从尿中排出。口服摄入的,浓度峰值在240 min观察到,峰浓度、消除半衰期和表观分布容积分别为4.6 ug/mL、310 min和0.44 mL/g。血浆中也存在外源CS部分消化生成的Mr小于5×103的单糖、寡糖和多糖。这项研究表明,口服摄入的药物分别以约10%和20%的高Mr和低Mr衍生物被吸收。与实验动物的研究结果相比较,部分解聚的CS的代谢变化趋向,在人体和实验动物体内是相似的。
Mitsuhiku Kubo等报道,口服摄入的CS部分在胃肠道内被吸收,其余随粪便排泄。哺乳动物循环CS的主要代谢器官是肝脏,但确切机制仍不清楚。口服摄入CS的大部分在消化过程中会水解成单糖,但仍有较小量的二糖、寡糖和多糖残存。有些组分会达及特殊嗜向性组织,如软骨和其他富含GAG的组织。口服摄入CS的吸收,取决于糖链长度(Mr)和电荷密度,引人关注的是CS对关节的嗜向性在其口服摄入后被证实。当人体口服摄入131I标记的CS,可在滑液和关节中观察到高水平131I标记的CS,人体中这种嗜向性也被口服摄入99mTc-CS的单光子发射计算机化断层成像(single photon emission computed tomography,SPECT)分析所证实。
对于口服CS在人体和动物体内生物利用度的不同报道和争议,可能的解释是实验的分析方法不一,用于研究的CS样本的结构和性质以及动物物种的不同。
本文作者为王浩,编辑发布时有删减,同时未附参考文献。Bioπ中国美肤科学传播平台发布本文只是为了传递更多的信息,不代表有任何倾向性的暗示或意见,仅供读者参考。
THE END
指导单位:中国香料香精化妆品工业协会
受托运营:中国香妆融媒体
京ICP备2025131973号